Mieux comprendre la perméabilité intestinale ?
La perméabilité intestinale est un phénomène de plus en plus étudié, en lien avec l’équilibre du microbiote et certaines fonctions digestives ou immunitaires. Comprendre ce mécanisme est essentiel pour adopter des stratégies nutritionnelles favorisant le bon fonctionnement intestinal.
Qu’est-ce que la perméabilité intestinale ?
Le syndrome d’hyperperméabilité intestinale, aussi appelé « intestin perméable », désigne une augmentation de la porosité de la paroi intestinale, notamment au niveau de l’intestin grêle. Cette barrière joue normalement un rôle de filtre sélectif, laissant passer les nutriments tout en bloquant les molécules indésirables.
Lorsque cette fonction barrière est altérée, certains composés non souhaités peuvent traverser la paroi, provoquant une stimulation du système immunitaire et des déséquilibres fonctionnels.
Des ajustements alimentaires appropriés peuvent améliorer la perméabilité intestinale en quelques mois 1. Bien que cette condition puisse entraîner des troubles importants, elle est réversible en 4 à 6 mois grâce à un protocole nutritionnel adapté.
Ce syndrome suscite un intérêt croissant en France, bien qu’il fasse déjà partie intégrante des critères diagnostiques dans des pays comme les États-Unis.
Quels sont les symptômes des troubles de la perméabilité intestinale ?
Une perméabilité intestinale excessive peut s’accompagner de signes variés, bien que non spécifiques. Il peut s’agir de troubles digestifs tels que ballonnements, inconfort intestinal ou transit irrégulier. Certaines personnes rapportent également une sensation de fatigue inexpliquée, une baisse de concentration ou une humeur fluctuante 2. D’autres signes peuvent inclure une sensibilité accrue à certains aliments ou des déséquilibres cutanés, notamment chez les personnes ayant un terrain sensible 3.
Il s’agit entre autres :
- Des troubles gastro-intestinaux type diarrhées, ballonnements, douleurs…
- Un syndrome de l’intestin irritable (SII) ou syndrome du côlon irritable (SCI) ou colopathie fonctionnelle.
- Des maux de tête, du brouillard cérébral, une perte de mémoire.
- Une fatigue généralisée qui apparaît parfois suite à une stimulation excessive du foie.
- De l’arthrite ou des douleurs articulaires.
- Des troubles de l’humeur, dépression, anxiété.
- Des déséquilibres hormonaux tels que le syndrome prémenstruel.
Des perturbations du système immunitaire peuvent également s’exprimer sous forme :
- d’allergies (asthmes, eczéma, rhinite…),
- d’affectations tissulaires (mycoses cutanées, vaginales…),
- d’intolérances alimentaires (gluten, caséine…),
- de pathologies auto-immunes (diabète de type I, lupus, maladies inflammatoires chroniques de l’intestin MICI – maladie de Crohn (MC) et rectocolite hémorragique (RCH)… chez les personnes présentant une prédisposition génétique.
Quels sont les facteurs qui engendrent un déséquilibre intestinal ?
Dans notre mode de vie moderne, certains facteurs favorisent un déséquilibre intestinal (dysbiose et/ou candidose) qui va engendrer une perméabilité intestinale :
- Le stress chronique est l’un des facteurs les plus reconnus pour perturber la fonction barrière intestinale 4.
- Une alimentation déséquilibrée, pauvre en fibres et riche en sucres raffinés, peut aggraver le phénomène 5.
- Certaines carences nutritionnelles, notamment en zinc, vitamine A ou Vitamine D, influencent négativement la régénération des cellules intestinales 6.
- L’alcool, le tabac, la sédentarité ou la prise répétée de certains médicaments (comme les AINS ou les antibiotiques) peuvent aussi impacter la santé de l’épithélium intestinal 7.
De nombreux facteurs du mode de vie moderne peuvent perturber l’équilibre intestinal. Voici les plus courants :
- Stress aigu ou chronique, reconnu comme cause majeure d’hyperperméabilité intestinale
- Carences en nutriments : vitamine A, vitamine D, zinc
- Consommation excessive de sucre, notamment le fructose
- Consommation excessive d’alcool
- Gluten (chez les personnes présentant une sensibilité ou une intolérance)
- Substances toxiques et polluants environnementaux
- Inflammation chronique
- Diabète et troubles endocriniens
- Agents infectieux et toxines
- Vieillissement physiologique et déficit immunitaire
- Grossesse
- Activités sportives intenses
- Traitements médicamenteux, en particulier les antibiotiques
- Prise régulière d’anti-inflammatoires non stéroïdiens (AINS)
- Alimentation déséquilibrée
- Ces éléments agissent souvent en synergie et peuvent affaiblir la barrière intestinale s’ils ne sont pas compensés par une hygiène de vie adaptée.

Quelles sont les causes de la perméabilité intestinale ?

Les causes de porosité intestinale sont nombreuses :
Dysbiose intestinale:
Principale cause de l’hyperperméabilité intestinale, la dysbiose est un déséquilibre entre souches commensales et souches pathogènes au niveau de la flore intestinale qui peut notamment altérer les fonctions barrières de la paroi et perturber de nombreuses fonctions biologiques 8.
Candidose intestinale:
Des levures et des champignons microscopiques comme le Candida albicans sont naturellement présents dans l’intestin.
Leur sur prolifération peut contribuer à des perturbations des fonctions physiologiques importantes 9.
Gluten:
Il participe à la dysbiose intestinale :
Pour les personnes qui sont intolérantes au gluten, il a une action directe d’inflammation de la muqueuse car il altère les cellules épithéliales.
Pour les personnes qui en consomment trop, il induit une surproduction de zonuline et donc un relâchement des jonctions serrées 10.
Zonuline:
Le gluten et le diabète de type I sont des déclencheurs de la libération de Zonuline, protéine provoquant le relâchement des jonctions serrées en cas de production accrue 11.
Le processus inflammatoire issu de la dysbiose, de la candidose et/ou du gluten altère les jonctions serrées, ce qui entraîne une hyperperméabilité de la paroi intestinale. Celle perméabilité intestinale exagérée facilitera le passage de xénobiotiques (molécules étrangères à l’organisme) dans le système circulatoire.
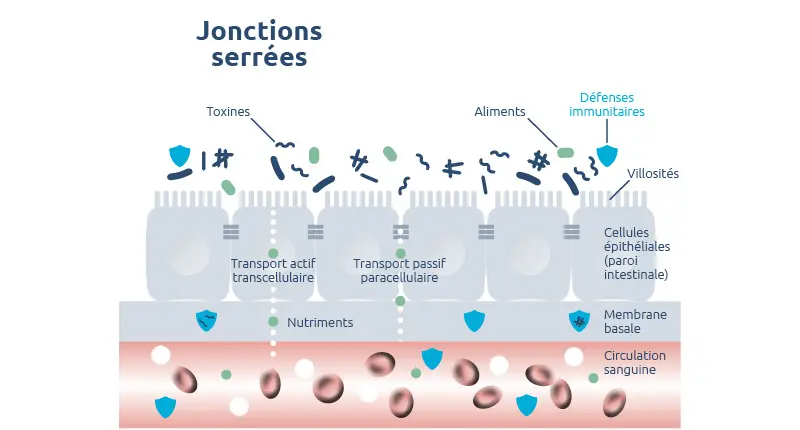
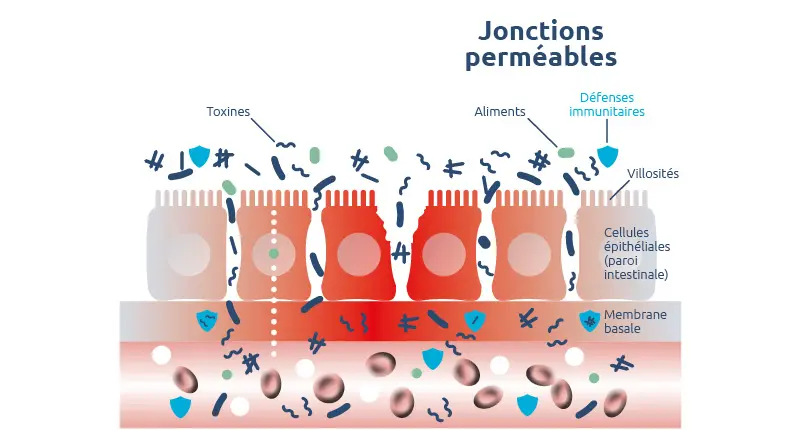
Jonctions relâchées = hyperperméabilité intestinale
En temps normal, les jonctions serrées ne laissent passer qu’un nombre réduit de petites molécules (60 Å (ångström) = 6 nanomètres maximum). Il arrive toutefois que les jonctions se relâchent et que l’espace entre les entérocytes s’accroisse : la perméabilité augmente et des molécules de taille plus importante peuvent franchir la barrière intestinale 12.
S’il se prolonge dans la durée, ce passage anormal de grosses molécules est appelé syndrome d’hyperperméabilité intestinale (Leaky gut syndrom, en anglais). Le dérèglement est généralement progressif et peut avoir de multiples causes.
De nombreux travaux sont en cours pour préciser son impact physiologique, mais il est d’ores et déjà impliqué dans l’étiologie de diverses pathologies 13.
Nouveaux développements dans la recherche sur la perméabilité intestinale
La recherche scientifique sur la perméabilité intestinale progresse rapidement, révélant de nouvelles stratégies pour renforcer la barrière intestinale et prévenir les complications associées. Par exemple, certaines études explorent l’utilisation de prébiotiques et de probiotiques spécifiques pour restaurer l’équilibre du microbiote intestinal, réduisant ainsi la perméabilité intestinale 14.
De plus, des approches basées sur des modifications diététiques ciblées, comme l’augmentation de l’apport en fibres solubles et la réduction de la consommation de gluten et de sucres raffinés, montrent des résultats prometteurs dans la gestion de ce syndrome 15.
Enfin, des nutriments comme la glutamine ou le zinc jouent un rôle clé dans le maintien de la structure des entérocytes 16. Ces avancées offrent de nouvelles perspectives pour ceux qui souffrent de troubles liés à la perméabilité intestinale.
Agir contre l’hyperperméabilité intestinale
Plusieurs approches complémentaires, peuvent participer à la reconstitution et l’entretien de la paroi intestinale (entérocytes, jonctions serrées), mais aussi de la flore microbienne commensale (microbiote intestinal) :
- Un rééquilibrage physiologique via des solutions naturelles synergiques : compléments nutritionnels et microbiotiques (appelés communément probiotiques)
- Une meilleure gestion des situations de stress professionnels ou personnels (thérapies, yoga, méditation, hypnose…).
- Une meilleure alimentation, en évitant les aliments trop riches (sucrés, gras…), les produits ultra-transformés et en privilégiant la consommation de fibres.
- Une bonne hygiène de vie, en limitant la consommation d’alcool et de tabac, en respectant le temps de sommeil et en pratiquant régulièrement des activités physiques.
- La perméabilité intestinale est un phénomène complexe et multifactoriel qui peut avoir de graves répercussions sur la santé générale. Une meilleure compréhension des causes et des facteurs aggravants, ainsi que des stratégies efficaces pour renforcer la barrière intestinale, est essentielle pour prévenir et traiter ce syndrome. Avec des solutions naturelles, il est possible de restaurer l’intégrité de la paroi intestinale et d’améliorer le bien-être général.
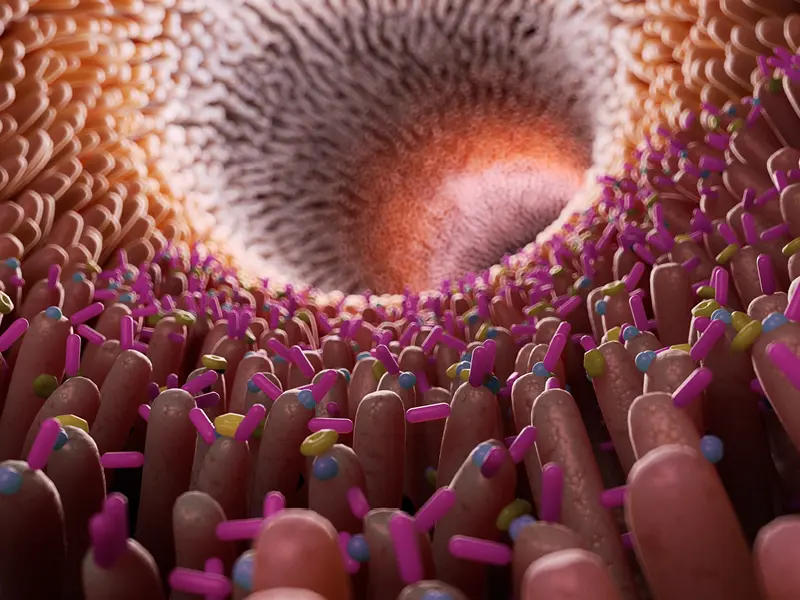
L’intestin grêle, filtre biologique sélectif
Situé dans le prolongement de l’estomac, l’intestin grêle a pour principale fonction d’absorber l’eau et les nutriments issus de l’alimentation, tout en empêchant la pénétration dans l’organisme de microbes pathogènes, de macromolécules et de toxines. Ce rôle de filtre sélectif est assuré par une vaste couche de cellules épithéliales: les entérocytes qui reliées entre elles par des jonctions serrées.
Les entérocytes réalisent un transport transcellulaire actif des nutriments jusqu’à l’organisme. Ils produisent des enzymes capables de fractionner les grosses molécules (macromolécules) apportées par l’alimentation en molécules plus petites (acides aminés, sucres simples et acides gras), avant absorption et passage dans la circulation sanguine.
Les jonctions serrées permettent un transport passif paracellulaire. L’eau, les ions et certaines molécules de petite taille empruntent cette voie pour réguler les mécanismes biochimiques du corps humain.
L’intestin grêle en chiffres
- 4 à 7 mètres de longueur, soit près de 80% de la longueur totale de l’intestin (intestin grêle + côlon).
- 200 m² environ de surface (32 m² selon certaines études), grâce aux villosités et microvillosités structurant le tissu épithélial.
- 40 tonnes d’aliments ingérés pendant une vie.
- 100 000 milliards de microorganismes composant le microbiote, dont 200 espèces différentes de bactéries.
- 200 millions de neurones formant un système nerveux entérique communiquant de manière étroite avec le système nerveux central.
Références scientifiques
- Bischoff, S. C., Barbara, G., Buurman, W., et al. (2014). Intestinal permeability – a new target for disease prevention and therapy. BMC Gastroenterology, 14, 189. https://doi.org/10.1186/s12876-014-0189-7
- Maes, M., Kubera, M., & Leunis, J. C. (2008). The gut-brain barrier in major depression: intestinal mucosal dysfunction with an increased translocation of LPS from gram negative enterobacteria (leaky gut) plays a role in the inflammatory pathophysiology of depression. Neuro endocrinology letters, 29(1), 117–124.
- Mu, Q., Kirby, J., & Reilly, C. (2017). Leaky Gut As a Danger Signal for Autoimmune Diseases. Frontiers in Immunology, 8, 598. https://doi.org/10.3389/fimmu.2017.00598
- Konturek, P. C., Brzozowski, T., & Konturek, S. J. (2011). Stress and the gut: pathophysiology, clinical consequences, diagnostic approach and treatment options. Journal of physiology and pharmacology : an official journal of the Polish Physiological Society, 62(6), 591–599.
- Spruss, A., & Bergheim, I. (2009). Dietary fructose and intestinal barrier: potential risk factor in the pathogenesis of nonalcoholic fatty liver disease. The Journal of nutritional biochemistry, 20(9), 657–662. https://doi.org/10.1016/j.jnutbio.2009.05.006
- Skrovanek, S., DiGuilio, K., Bailey, R., Huntington, W., Urbas, R., Mayilvaganan, B., Mercogliano, G., & Mullin, J. M. (2014). Zinc and gastrointestinal disease. World journal of gastrointestinal pathophysiology, 5(4), 496–513. https://doi.org/10.4291/wjgp.v5.i4.496
- Ferrier, L., Bérard, F., Debrauwer, L., Chabo, C., Langella, P., Buéno, L., & Fioramonti, J. (2006). Impairment of the intestinal barrier by ethanol involves enteric microflora and mast cell activation in rodents. The American journal of pathology, 168(4), 1148–1154. https://doi.org/10.2353/ajpath.2006.050617
- Genser, L., Poitou, C., Brot-Laroche, É., Rousset, M., Vaillant, J. C., Clément, K., Thenet, S., & Leturque, A. (2016). L’altération de la perméabilité intestinale : chaînon manquant entre dysbiose et inflammation au cours de l’obésité ? [Alteration of intestinal permeability: the missing link between gut microbiota modifications and inflammation in obesity?]. Medecine sciences : M/S, 32(5), 461–469. https://doi.org/10.1051/medsci/20163205012
- Yamaguchi, N., Sugita, R., Miki, A., Takemura, N., Kawabata, J., Watanabe, J., & Sonoyama, K. (2006). Gastrointestinal Candida colonisation promotes sensitisation against food antigens by affecting the mucosal barrier in mice. Gut, 55(7), 954–960. https://doi.org/10.1136/gut.2005.084954
- Fasano, A. (2012). Zonulin, regulation of tight junctions, and autoimmune diseases. Annals of the New York Academy of Sciences, 1258(1), 25–33. https://doi.org/10.1111/j.1749-6632.2012.06538.x
- Odenwald, M. A., & Turner, J. R. (2013). Intestinal permeability defects: is it time to treat?. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association, 11(9), 1075–1083. https://doi.org/10.1016/j.cgh.2013.07.001
- Groschwitz, K. R., & Hogan, S. P. (2009). Intestinal barrier function: molecular regulation and disease pathogenesis. The Journal of allergy and clinical immunology, 124(1), 3–22. https://doi.org/10.1016/j.jaci.2009.05.038
- Helander, H. F., & Fändriks, L. (2014). Surface area of the digestive tract – revisited. Scandinavian journal of gastroenterology, 49(6), 681–689. https://doi.org/10.3109/00365521.2014.898326
- Liu, Y., Fatheree, N. Y., Mangalat, N., & Rhoads, J. M. (2012). Lactobacillus reuteri strains reduce incidence and severity of experimental necrotizing enterocolitis via modulation of TLR4 and NF-κB signaling in the intestine. American journal of physiology. Gastrointestinal and liver physiology, 302(6), G608–G617. https://doi.org/10.1152/ajpgi.00266.2011
- Slavin J. (2013). Fiber and prebiotics: mechanisms and health benefits. Nutrients, 5(4), 1417–1435. https://doi.org/10.3390/nu5041417
- Rao, R., & Samak, G. (2012). Role of Glutamine in Protection of Intestinal Epithelial Tight Junctions. Journal of epithelial biology & pharmacology, 5(Suppl 1-M7), 47–54. https://doi.org/10.2174/1875044301205010047